研究概要
薬理学分野では,体性感覚(特に,痛みと痒み)の受容・伝達・処理の仕組みとその破綻による慢性感覚異常メカニズムを,遺伝子工学,生体イメージング,電気生理学,光遺伝学,行動薬理学的実験技術などを組み合わせた分子~細胞~個体レベルの包括的な研究から明らかにしていきます。そして,治療コンセプトを変えるような創薬標的を発見し,産学官連携共同研究から新しい医薬品の創出に貢献していきます。
私たちの研究の特色は,痛みと痒みのメカニズムを神経細胞だけでなく,その周りに存在するグリア細胞の働きに注目していることです。グリア細胞は,発見当初,神経と神経のすき間を埋める糊のようなものとされ,長らくその役割は不明でした。しかし近年,グリア細胞は神経の働きに大切な細胞で,病気にも深く関わることが少しずつ分かってきました。私たちは,グリア細胞のミクログリアとアストロサイトに注目し,これらが慢性的な痛みや痒みに非常に重要な役割を有していることを世界に先駆けて明らかにしてきました(「主要な研究成果」を参照)。これらの成果から,従来の説が大きく変わり,グリア細胞を入れた新しいメカニズムが考えられるようになりました。さらに,グリアが神経活動そのものに大きな影響力を有する細胞であることを示した重要な例ともなりました。現在,そのメカニズムの全容解明に向けて研究を進めています。一方,グリア細胞は正常状態でも,痛みや痒みの伝達経路にたくさん存在しています。普段の感覚情報伝達でグリア細胞はどんな働きをしているのでしょうか?それが解明できれば,グリア細胞の生物学的存在意義も見えてくるかもしれません。
痛みの研究
痛みは身体の傷や障害を知らせる大切な警告信号ですが,末期がんや糖尿病,脳卒中の後遺症,脊髄損傷,帯状疱疹後などで発症する慢性化した堪え難い痛みは,患者の生活の質(QOL)を低下させ,また原因疾患の治療にも多大な悪影響を及ぼしてしまいます。そのような慢性疼痛は,神経系の損傷や機能異常に起因することから,「神経障害性疼痛」と呼ばれます。その症状は衣服が肌に触れるような刺激で痛みを誘発する(異痛症:アロディニア)という非常に厄介なもので,モルヒネにさえ抵抗性を示す例が少なくありません。しかし,その発症機序は不明で,有効な治療法もありません。この救われ難い痛みに苦しんでいる患者数は我が国では推定約600万人,世界では数千万人にものぼるため,神経障害性疼痛の発症維持における新しいメカニズムの発見と,それに基づいたイノベーティブな創薬は我が国のみならず全世界共通の重要課題と言えます。
皮膚などの末梢組織からの痛覚を含む感覚情報は,一次求心性神経を介して脊髄後角に入力します。脊髄後角には局所的な神経回路を形成する多くの介在神経が存在し,末梢組織からの感覚情報は適切に処理・統合され,脳へ投射する神経を介して脳へと出力します。慢性疼痛は,急性の痛覚信号が持続的に発生するためという単純なものではなく,神経障害後に脳や脊髄で起こる多種多様な構造・機能的変化と,その結果生じる神経活動異常が原因と考えられています。私たちは,神経障害によって感覚情報伝達経路の「どの部位」で「どの細胞」が「どのように」変化するのかを研究しています。
神経
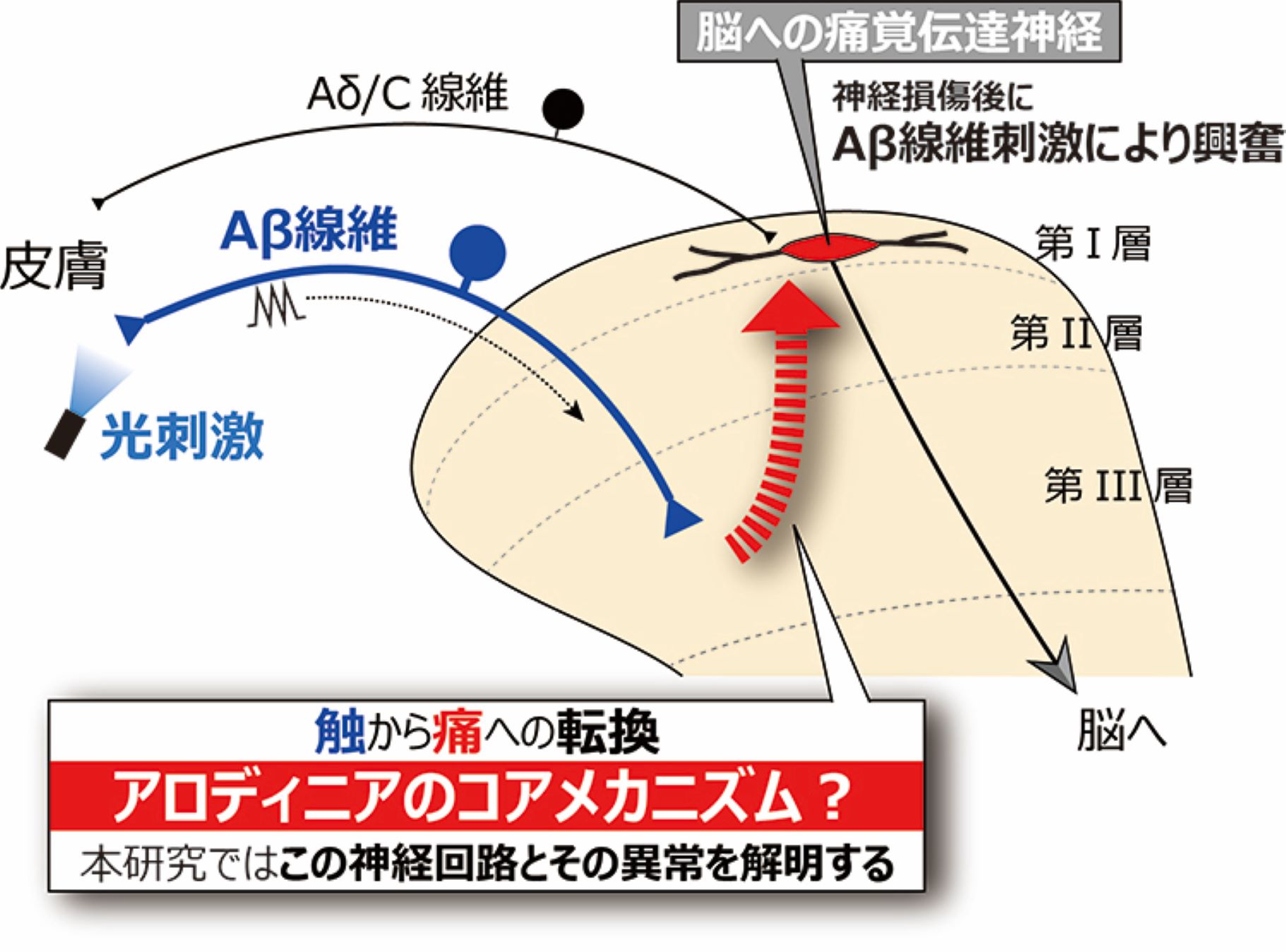
神経障害性アロディニアは,触刺激で誘発される痛みであるため,触刺激を脊髄や脳へ伝える一次求心性神経(Aβ線維など)を介した神経経路の異常が原因の一つと想定されています。しかし,そのメカニズムはよく分かっていません。その原因の一つは,Aβ線維の活動を選択的に制御する方法がなかったためです。私たちは,この問題を解決のためにオプトジェネティックス(光遺伝学)法を採用しました。具体的には,Aβ線維にチャネルロドプシン2を発現するラット(東北大学・八尾寛教授が開発)で神経障害性疼痛モデルを作製し,足裏の皮膚に光をあてることでAβ線維を刺激します。その結果,このラットは疼痛行動(アロディニア)を呈することを明らかにしました(2018年eNeuro論文を参照)。この行動はモルヒネで抑制されなかったため,このモデルが神経障害性アロディニアのメカニズム解明と新薬開発に資する新規評価法となりえると考えています。さらに,通常ではAβ線維刺激で興奮することのない脊髄後角第I層神経(痛みを脳へ伝える神経)が興奮することも明らかにし,それを仲介する神経サブセット(NPYプロモーターで制御される神経:NpyP神経)も特定しました(2021PNAS論文)。NpyP神経は抑制性の介在神経で,通常はGABAを介して第I層神経を抑制しています。しかし,神経損傷後では,NpyP神経の静止膜電位が深くなるため,活動しにくい状態となり,結果として,第I層神経への抑制効果が弱くなり,アロディニアが出現すると考えています。実際に,正常ラットのNpyP神経を除去するだけでアロディニアが発症することも見いだしました。すなわち,この神経サブセットは神経障害性アロディニアに直結する細胞であると考えられます。現在,脊髄後角の神経とグリア細胞に注目して,どのようなメカニズムでこの現象が起こるのかを研究しています。
ミクログリア
皮膚からの感覚情報は,神経によって脊髄と脳へ伝えられますが,実は神経以外にも様々な細胞が関わっています。私たちは,2003年に脊髄のミクログリアが神経障害性疼痛の発症に必須であることを世界で初めて発見しました(2003年Nature論文)。そしてそれ以降,ミクログリアが発現する受容体や転写因子などを数多く特定し,それらの役割に関する研究から(「主要な研究成果」を参照),神経障害性疼痛の発症メカニズムを明らかにしてきました(2018年Nat Rev Neurosci総説)。
しかし,神経障害性疼痛ではアロディニアが特徴的ですが,ミクログリアがどのように触刺激が痛み情報に誤変換するのか,その仕組みはまだよく分かっていません。そこで,上記の新しい神経障害性アロディニア評価モデルなどを用い,ミクログリアが作り出す新しい神経活動異常を突き止め,神経障害性疼痛の発症メカニズムを明らかにしていきます。
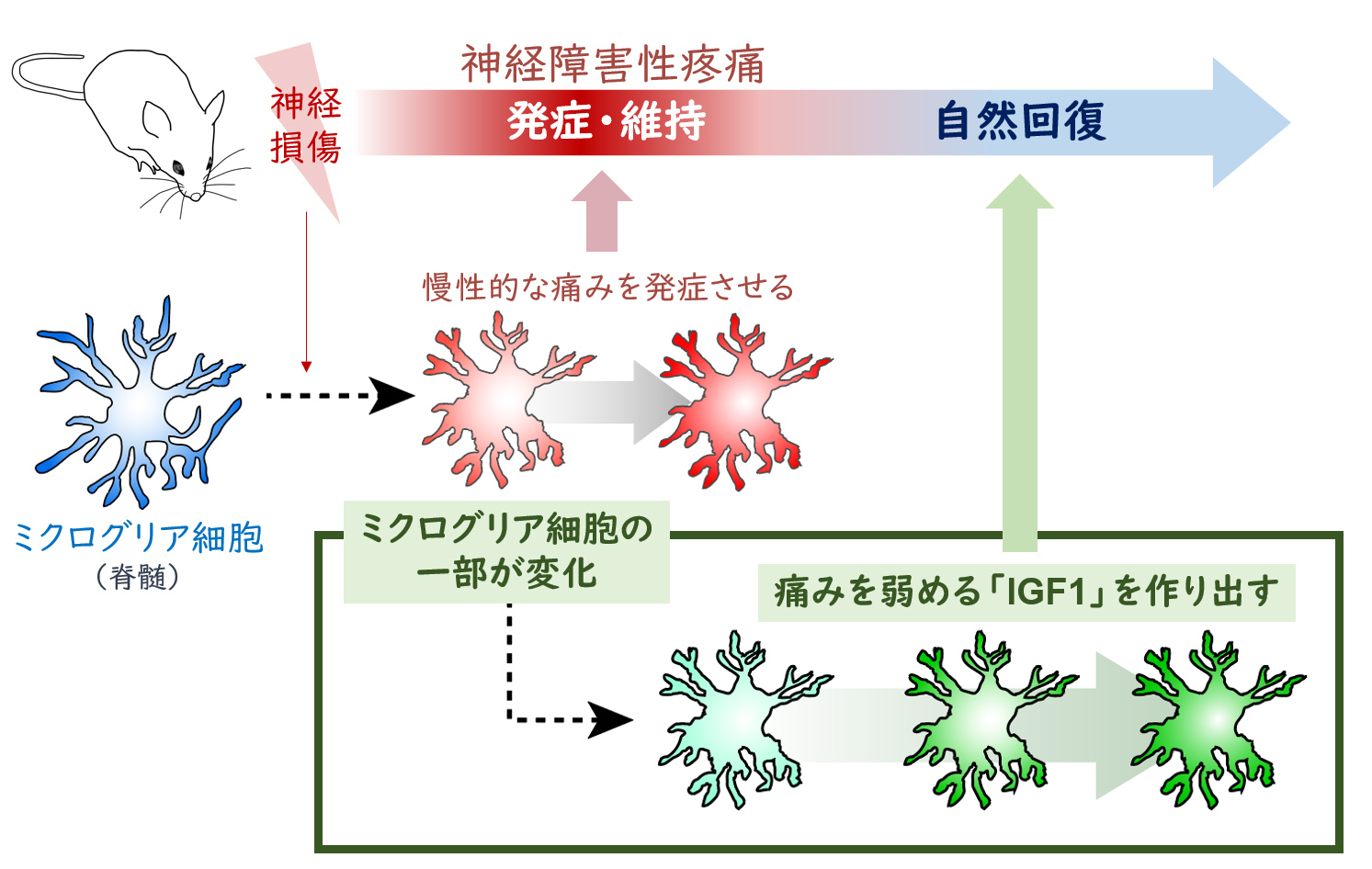
さらに,近年ミクログリアのサブグループの存在や特徴が次々と示されています。私たちは,神経損傷によって痛みが発症した後に,ミクログリアの一部が変化して,ある特殊なサブグループ(CD11c陽性)をつくりはじめることを発見しました(2022年Science論文)。その変化のタイミングは,慢性疼痛が自然に和らぐ時期と相関し,このサブグループを脊髄から除去した場合,回復が見られず,痛みが非常に長く持続することを見つけました。したがって,これまで慢性疼痛を発症させる原因とされてきたミクログリア細胞でしたが,その一部は状況に応じて変化し,痛みを和らげるという新たな作用を獲得することを明らかにしました。これは,長引く痛みへの身体の対処能力のひとつだと考えられます。現在,このミクログリアサブセットの出現メカニズムや痛みの緩和メカニズムなどを研究し,このサブセットを標的にした創薬の実現を目指していきます。
アストロサイト
アストロサイトは,非常に多くの突起を有し,脳表面や脳血管,シナプスに接触しています。シナプス構造の維持だけでなく,多くの神経伝達物質受容体を発現し,神経からのシグナルを受け,さらにシナプス活動に影響を与えるグリア伝達物質も放出することが知られています。
神経損傷後早期から活性化するミクログリアとは対照的に,アストロサイトは比較的後期から活性化(形態変化やGFAPレベルの増加)し,神経障害性疼痛の維持に大切であることを明らかにしました(2011年BRAIN論文)。アストロサイトの研究から神経障害性疼痛の維持メカニズムを解明できることが期待されます。
さらに最近,皮膚からの感覚信号が入力する脊髄後角の表層に選択的に存在するアストロサイトのサブセットを発見しました(2020年Nat Neurosci論文)。この細胞には,皮膚からの痛覚信号を過敏化する力があることも突き止めました。不思議なことに,このアストロサイトは,痛みを抑えるとされてきたノルアドレナリン神経で刺激されることもわかりました。すなわち,これまで痛みを抑える作用が常識であったノルアドレナリン神経に,まったく逆の作用があることがこのアストロサイトの発見により明らかとなったのです。脊髄後角でアストロサイトが多様化する意味は何か,このサブセットを標的にした鎮痛薬開発は可能かなど,現在研究を進めています。
痒みの研究
アトピー性皮膚炎に代表される慢性的な痒みもまた効果的な治療薬に乏しい疾患です。皮膚疾患や一部の内臓疾患などの痒みは強く慢性的で,過剰な引掻き行動が起こり,その結果皮膚炎が発症,さらに周囲の皮膚にも炎症が広がり,さらに強い痒みが出てしまいます(痒みと掻破の悪循環)。しかし,この慢性的な痒みの神経化学的メカニズムは全く分かっていません。
アストロサイト
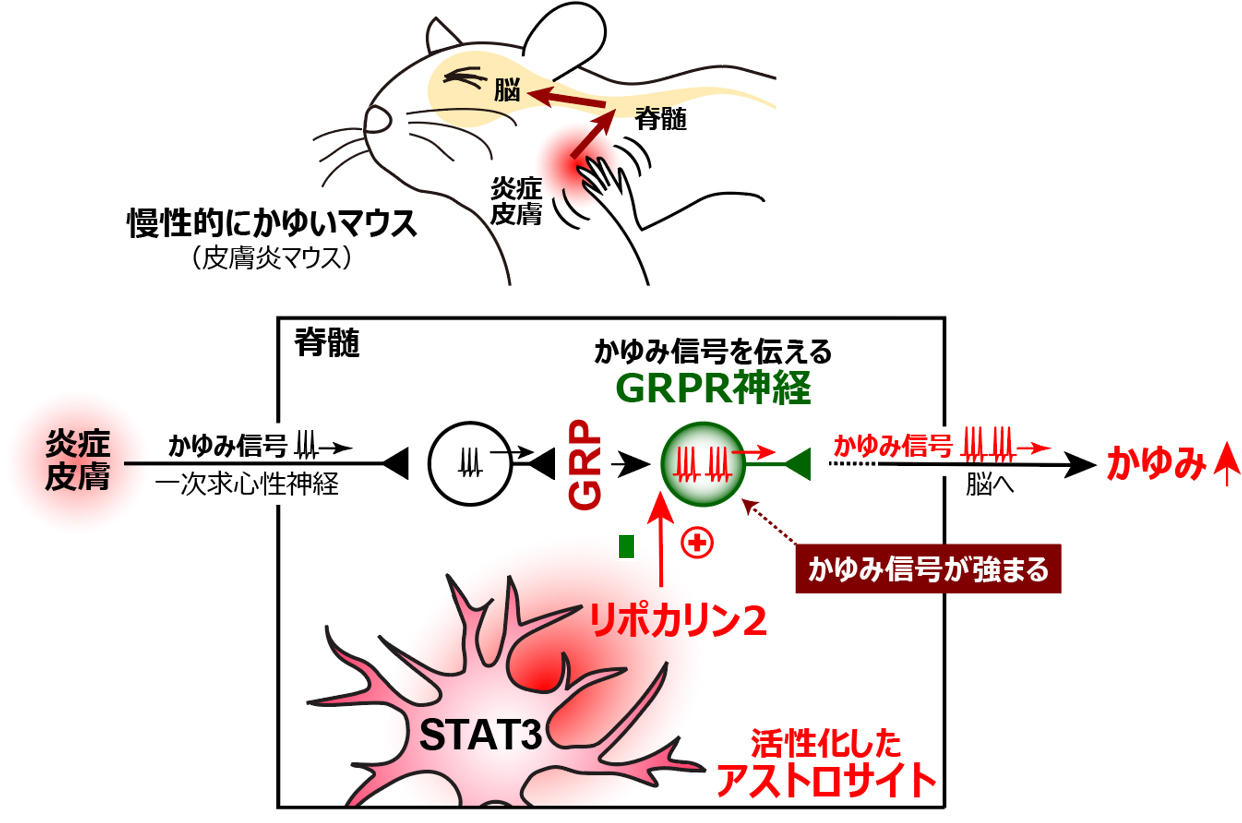
私たちは,皮膚を激しく引掻くアトピー性皮膚炎モデルマウスを用いて研究を行い,そのマウスの脊髄後角でアストロサイトが長期にわたって活性化し,痒みの慢性化に関与していることを世界で初めて明らかにしました(2015年Nat Med論文)。アストロサイトの活性化メカニズムとして,炎症皮膚と脊髄を繋ぐ一次求心性神経で発現増加するインターロイキン-6(IL-6)が脊髄後角のアストロサイトに作用して1型IP3受容体やTRPCチャネルを介する細胞内カルシウム上昇を起こし,長期的なSTAT3活性化を誘導することを明らかにしました(2021年JACI論文)。活性化したアストロサイトはリポカリン2という因子を放出し,それが脊髄後角で痒み信号の伝達に大切な神経細胞(ガストリン放出ペプチド受容体GRPRを発現する)に作用し,その活動を強めてしまうことを明らかにしました(2020年JACI論文)。これらの研究成果は,アトピー性皮膚炎に伴う慢性的な痒みの新しいメカニズムとして注目されています。今後,脳や脊髄後角の神経-アストロサイト相互作用の研究から,従来の視点や研究アプローチからは見出せない,慢性掻痒の全く新しいメカニズムを明らかにし,その成果をベースに新しい視点を持った痒み治療薬の開発を目指します。

